Hóa trị của Na, C, O, N, S, Cl, Al, K, Mg
Hóa trị của một nguyên tố là thước đo khả năng kết hợp của nguyên tử với các nguyên tử khác để tạo ra các phân tử hoặc hợp chất. Hóa trị cho biết có bao nhiêu nguyên tử nữa có thể nối thành liên kết cộng hóa trị được gọi là hóa trị trong hóa học.
Thuật ngữ này được sử dụng lần đầu tiên vào năm 1868, được sử dụng để thể hiện cả tiềm năng rộng lớn của việc kết hợp một nguyên tố và giá trị số của sức mạnh của sự kết hợp. Vì phần lớn các liên kết được tạo ra bởi sự trao đổi của các electron hóa trị nên hóa trị được định nghĩa là số lượng electron.
Bạn đang xem: Hóa trị của Na, C, O, N, S, Cl, Al, K, Mg

Hóa trị là gì?
Hóa trị của một nguyên tử bằng số electron hóa trị mà nguyên tử này có thể thu được hoặc mất đi trong các phản ứng hóa học. Ví dụ, lượng nguyên tử hydro, nguyên tử clo hoặc gấp đôi số nguyên tử oxy mà một nguyên tử của một nguyên tố có thể kết hợp được gọi là hóa trị của nó.
Hóa trị của một nguyên tố đề cập đến số lượng electron hóa trị trong nguyên tố đó tham gia vào các quá trình hóa học. Một hợp chất hóa học được tạo ra khi hai hoặc nhiều thành phần được kết hợp theo một tỷ lệ nhất định. Một hợp chất ổn định được hình thành khi một nguyên tử của một nguyên tố kết hợp với một số nguyên tử của nguyên tố khác.
Khái niệm về hóa trị
Các quỹ đạo (vỏ) khác nhau trong đó các electron được nhóm lại trong nguyên tử được ký hiệu bằng các chữ cái K, L, M, N, v.v. Các electron hóa trị là những electron được tìm thấy ở quỹ đạo hoặc lớp vỏ ngoài cùng của nguyên tử. Vì quỹ đạo ngoài cùng thường chứa nhiều năng lượng hơn các electron tìm thấy ở các quỹ đạo khác nên các electron hóa trị tham gia vào mọi phản ứng hóa học.
Lý thuyết Bohr-bury dự đoán rằng quỹ đạo ngoài cùng của nguyên tử sẽ chứa tối đa 8 electron. Tuy nhiên, rất ít hoặc không có hoạt động hóa học nào được thể hiện nếu quỹ đạo ngoài cùng được lấp đầy hoàn toàn. Khả năng phản ứng của nó giảm xuống gần như không có gì.
Khí hiếm ít phản ứng nhất vì quỹ đạo ngoài cùng của chúng được lấp đầy hoàn toàn. Tuy nhiên cách các nguyên tố hình thành cấu hình khí hiếm quyết định mức độ phản ứng của chúng. Nó cũng sẽ hỗ trợ trong việc tìm ra hóa trị của nguyên tử.
Cách tính hóa trị?
Bảng tuần hoàn cho thấy tất cả các thành viên của cùng một nhóm (cột) đều có hóa trị như nhau. Nếu chúng ta nhìn vào nhóm 8 trong bảng tuần hoàn, tất cả các nguyên tố đều đã đạt được bát tử và đã hoàn toàn chiếm giữ quỹ đạo ngoài cùng của chúng. Do đó, các nguyên tố của nhóm 8 không có hóa trị. Có ba cách chính để xác định hóa trị của các nguyên tố khác:
Quy tắc bát tử
Quy tắc bát tử được áp dụng nếu không thể xác định được hóa trị bằng bảng tuần hoàn. Theo nguyên tắc này, các nguyên tử của một nguyên tố hoặc hóa chất có xu hướng nhận hoặc mất electron trong hợp chất mà nó có mặt, làm tăng hoặc giảm số lượng electron ở quỹ đạo ngoài cùng của chúng. Số lượng electron ở quỹ đạo ngoài cùng của nguyên tử được giới hạn ở mức 8. Một nguyên tử được coi là ổn định nếu lớp vỏ ngoài cùng của nó có 8 electron.
Bảng tuần hoàn hóa học
Xem thêm : Top 5 sự thật về cung hoàng đạo nhà Khí
Với phương pháp này, đồ họa bảng tuần hoàn được sử dụng để tính hóa trị. Ví dụ: tất cả các kim loại trong cột 1 đều có hóa trị +1, bao gồm hydro, lithium, natri, v.v. Tương tự như vậy, tất cả các nguyên tố trong cột 17—bao gồm flo, clo và các nguyên tố khác đều có hóa trị 1. Trong cột 18, tất cả các khí hiếm đều có hóa trị 0 và trơ.
Công thức hóa học
Quy tắc bát tử là nền tảng của phương pháp này. Bằng cách nghiên cứu cách chúng tương tác hóa học với các nguyên tố khác có hóa trị đã biết, có thể xác định hóa trị của một số nguyên tố chuyển tiếp hoặc gốc tự do trong một phân tử nhất định. Cụ thể là xem cách nó kết hợp với hydro hoặc oxy để suy ra hóa trị.
Hóa trị của Na, C, O, N, S, Cl, Al, K, Mg
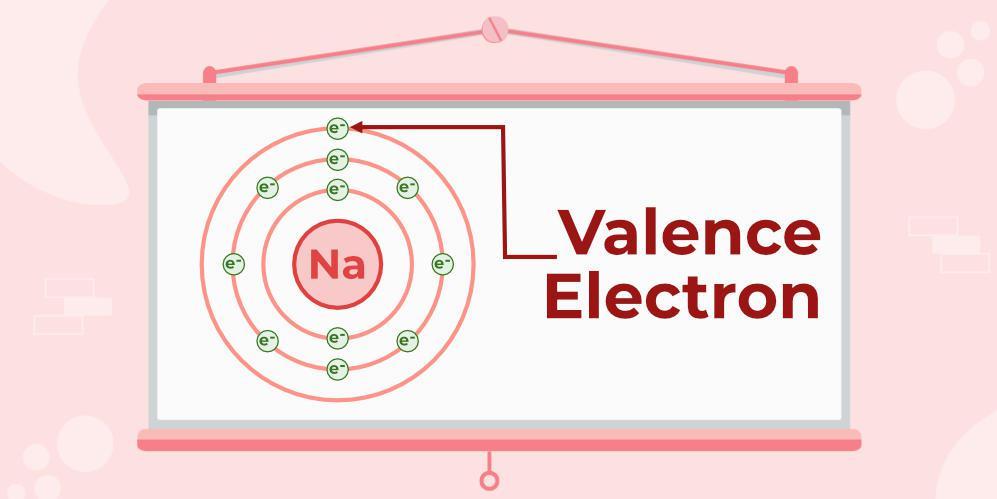
Hóa trị của Natri (Na)
Số nguyên tử của Na là 11 (K = 2; L = 8; M = 1). Chúng có 1 electron ở lớp vỏ ngoài cùng. Vì vậy, hóa trị của Natri là 1.
Hóa trị của cacbon (C)
Số nguyên tử của C là 6 (K = 2; L = 4). Chúng có 4 electron ở lớp ngoài cùng. Vậy hóa trị của Carbon là 4.
Hóa trị của của oxy (O)
Số nguyên tử của O là 8 (K = 2; L = 6; M= 0), chúng có 6 electron ở lớp vỏ ngoài cùng. Vậy hóa trị của Oxy là: 8 – 6 = 2.
Hóa trị của của nitơ (N)
Số nguyên tử của N là 7 (K = 2; L = 5; M= 0). Chúng có 5 electron ở lớp vỏ ngoài cùng. Vậy hóa trị của Nitơ là: 8 – 5 = 3.
Hóa trị của lưu huỳnh (S)
Xem thêm : Nằm mơ thấy cá chép, cá chép đỏ, vàng, hóa rồng, bị chết
Số nguyên tử của S là 16 (K = 2; L = 8; M = 6). Chúng có 6 electron ở lớp vỏ ngoài cùng. Vì vậy, hóa trị của Lưu huỳnh là 8 – 6=2.
Hóa trị của của clo (Cl)
Số nguyên tử của Cl là 17 (K = 2; L = 8; M = 7). Chúng có 7 electron ở lớp vỏ ngoài cùng. Vậy hóa trị của Clo là 8-7= 1.
Hóa trị của nhôm (Al)
Số nguyên tử của Al là 13 (K = 2; L = 8; M = 3). Chúng có 3 electron ở lớp vỏ ngoài cùng. Vậy hóa trị của Nhôm là 3.
Hóa trị của Kali (K)
Số nguyên tử của K là 19 (K = 2; L = 8; M = 8, N=1). Chúng có 1 electron ở lớp vỏ ngoài cùng. Vậy hóa trị của Kali là 1.
Hóa trị của Magiê (Mg)
Số nguyên tử của Mg là 12 (K = 2; L = 8; M = 2). Chúng có 2 electron ở lớp ngoài cùng. Vì vậy, hóa trị của Magiê là 2.

Bài viết liên quan:
- Cấu trúc của bảng tuần hoàn các nguyên tố hóa học
- Axit sunfuric (H2SO4) là gì? Ứng dụng của H2SO4
- Bảng hóa trị lớp 7, lớp 8, lớp 9, lớp 10 đầy đủ
Nguồn: https://duhochanquocchd.edu.vn
Danh mục: Khám Phá

/fptshop.com.vn/uploads/images/tin-tuc/172854/Originals/etc-la-gi-5.jpg)